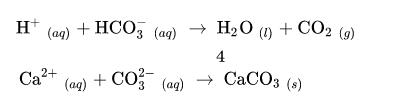什么是水的硬度?
水的硬度是水質參數的一個重要指標,它反映了除鈉、鉀離子以外所有溶解在水中的金屬離子濃度的總和。硬水是含有高濃度礦物質的水,尤其是含有高濃度的鈣和鎂。
工業界為避免礦物質在鍋爐、冷卻塔或其他處理水的設施中沉淀產生水垢而導致故障,經常對水的硬度做監測。日常生活中硬水會使肥皂及牙膏無法在水中起泡。
水的硬度種類:概括地說,水有暫時硬度和永久硬度兩個硬度,兩個硬度加起來,就是水的總硬度(total hardness)。
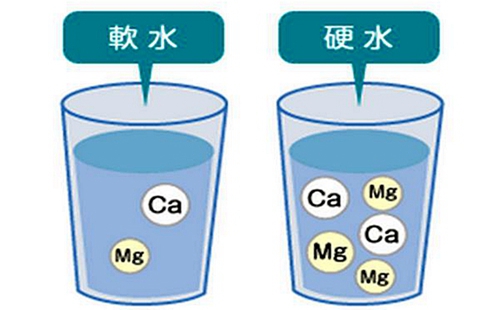
暫時硬度:如果我們加石灰水(即氫氧化鈣,Ca(OH)2)進硬水,或者把硬水煮沸,硬度出現下降的話,我們說這些下降了的硬度稱為"暫時硬度"。這些方法都會使鈣、鎂、碳酸氫鹽(HCO3−)等令水變硬的物質跑掉,或沉淀成固體物質。
煮沸方法
其中,碳酸鈣(CaCO3)在水中的溶解度和溫度成反比,即是溶液越熱,就會有越多的碳酸鈣沉淀出來。
加石灰
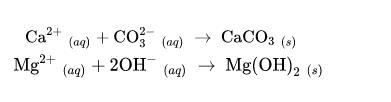
亦因為加熱時,會產生 CaCO3(s)。故此,如果自來水是硬水,在經過熱水爐加熱之后會有白色沉淀物(CaCO3(s),MgCO3(s))堵塞出水口,時間累積后會有危險。
永久硬度:由于含有鈣離子或者鎂離子的硫酸鹽或氯化鹽(氯化物)而產生的硬度,叫做永久硬度。這些硬度雖然不能用煮沸及加石灰方法來減低,但可以用其他方法,如離子交換(ion exchange)降低。
硬度的改變:如果水流過石灰,硬度就會增加;而如果流過泥煤,硬度就會下降。
由于肥皂或清潔劑分子帶有一個鈉離子,遇到硬水中的鈣、鎂離子時,會拋棄本身的鈉離子而與鈣、鎂離子結合,造成新的分子沒有清潔作用,轉而累積變成水垢,因此需要更多的肥皂或清潔劑才能達到清潔效果。鍋爐或者熱水爐在鈣離子與鎂離子與碳酸根或者是硫酸根結合產生的水垢稱為鍋垢。
水的硬度測定:水中硬度檢測常采用乙二胺四乙酸(EDTA)滴定法。
取適量水樣,將pH調整至10.0±0.1,加入少量指示劑,如Eriochrome Black T或Calmagite,此時水溶液會呈現酒紅色(為指示劑與水中部分金屬離子形成錯合物的顏色)。當加入EDTA滴定液時,EDTA會與游離的鈣或鎂離子生成溶解性的錯合物,當水中所有的鈣和鎂均形成錯合物后,再滴下的EDTA會搶走指示劑-金屬錯合物中的金屬離子并釋出指示劑,而使溶液由酒紅色變成指示劑本身于pH10之下所顯現的藍色,此時即為滴定終點。
與本滴定過程中必須有鎂離子存在方可產生正確的滴定終點,所以通常在緩沖溶液中會加入少量EDTA的鎂鹽,以供給足夠之鎂離子且無須做空白試驗的校正。另外,若不添加鎂鹽時也可使用反滴定方法,用過量的EDTA與鈣離子生成較為穩定的錯合物,之后再使用鎂離子或鋅離子溶液進行反滴定。
實驗中溶液pH值愈高,可增加終點辨色之靈敏度,但pH過高,會生成CaCO3與Mg(OH)2沉淀,另指示劑染料也會變色。故以EDTA滴定法測水中硬度,在pH 10.0±0.1可得滿意之結果,但滴定須在加入緩沖液后5分鐘內完成,使CaCO3沉淀之趨勢降至最低。
最后,由EDTA滴定用量換算求得水中硬度濃度,通常以mg CaCO3/L為單位表示。
根據世界衛生組織(WHO)所公布之硬水與軟水的基準,依換算碳酸鈣之量為標準,0~60mg/L為軟水,60 ~120mg/L為中等程度的軟水,120~180mg/L為硬水,大于180mg/L為超硬水。
由于自然水中除鈣、鎂離子外,其余的硬度離子存量不足3%,因此水的硬度通常定義為鈣、鎂離子的總和。在當今的世界標準中,水的硬度通常分為6個等級 (以CaCO3及德國度計算),中國現行的水的硬度單位與德國一致。
在日常生產及生活中,控制水的硬度對于產品品質及人體健康都有著顯著的影響。例如:紡織與印染工業要求用水的水質硬度低于3mmol/L,印染時水質硬度應低于0.35mmol/L。如果超過此硬度,水中的鈣、鎂鹽類會與肥皂發生作用,從而導致紡織品出現斑點、鮮艷度降低等問題。對于飲用水,高硬度的水則會導致泡茶時口感不佳。嚴重時,水具有苦澀味,飲用后可能導致腸胃不適。
參考資料:
曾昭桓、陳秀卿...等15位.環境分析-原理與應用
臺灣: 環境分析學會. 2012/04: 128–129 (中文)
- 聯系我們
-
- 全國統一服務熱線
400-086-0510- 企業郵箱
251677379@qq.com - 全國統一服務熱線



 全國銷售熱線:400-086-0510
全國銷售熱線:400-086-0510